乳腺癌的分层体系是多维度的,包含组织病理学分型、临床特征和进一步的分子特征。
- 基于组织病理学的分类:
a) 原位癌(carcinoma in situ):
- 导管原位癌(ductal carcinoma in situ, DCIS, 90%):
- 导管内癌的癌前病变;
- 单侧发生(Unilateral);
- 仅有10~30%会进展为侵袭性癌,但是没有合适的预测进展的标志物。
- 小叶原位癌(lobular carcinoma in situ, LCIS):
- 不属于癌前病变;
- 双侧发生;
- ER/PR(+);
- 小叶结构完整(lobular architecture intact)。 </ol></li></ol>
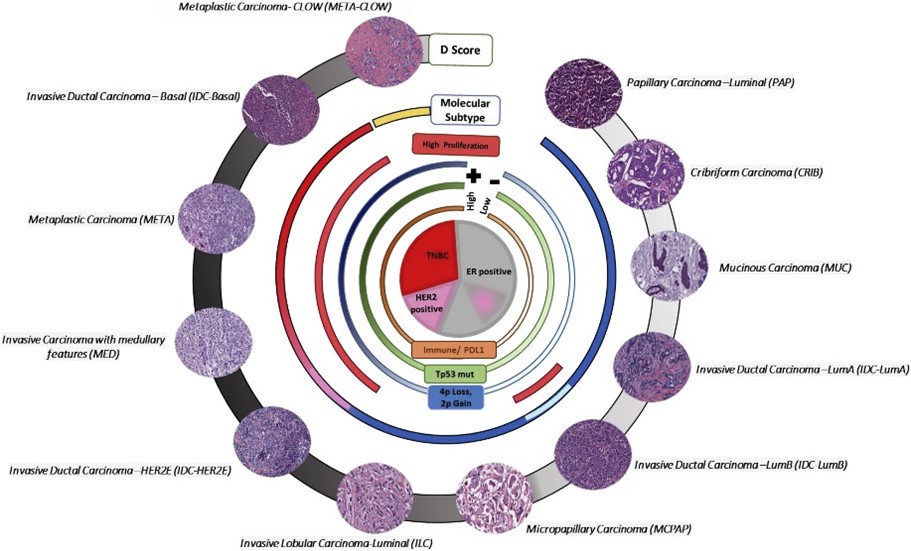
- 浸润性导管癌(invasive ductal carcinoma, IDC, 60%~75%):无特殊型是最常见的;
- 浸润性小叶癌(invasive lobular carcinoma, ILC, 10%~15%):小叶原位癌根据组织型学特征将其进一步分为经典型(classical)和多形型(pleomorphic)。
- 罕见浸润性乳腺癌(0.1%~7%):
- ER(+):小管癌(tubular);粘液癌(mucinous);神经内分泌癌(neuroendocrine);微乳头癌(micropapillary);
- ER(-):腺样囊性(adenoid cystic);化生性癌(metaplastic);髓样癌(medullary)。
c) Bloom-Richardson三级分类系统:分化程度(生长模式和核分裂象)、增殖活力(线粒体指数)。
- 临床分类:
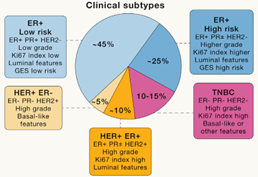
根据ER、PR和HER-2的表达,乳腺癌可以分类为:ER+(70%)、HER-2+(15%:70% ER+, 30%ER-;HER-2低表达乳腺癌(+~++但无ERBB2扩增)受到越来越多的关注)和TNBC(15%,根据EGFR和细胞角蛋白CK5/CK14的表达可以进一步分型)。
b) 浸润性癌(invasive carcinoma):
浸润性导管癌和浸润性小叶癌是完全不同的疾病,他们的病理学、基因组学、转移器官和治疗应答都有不同。
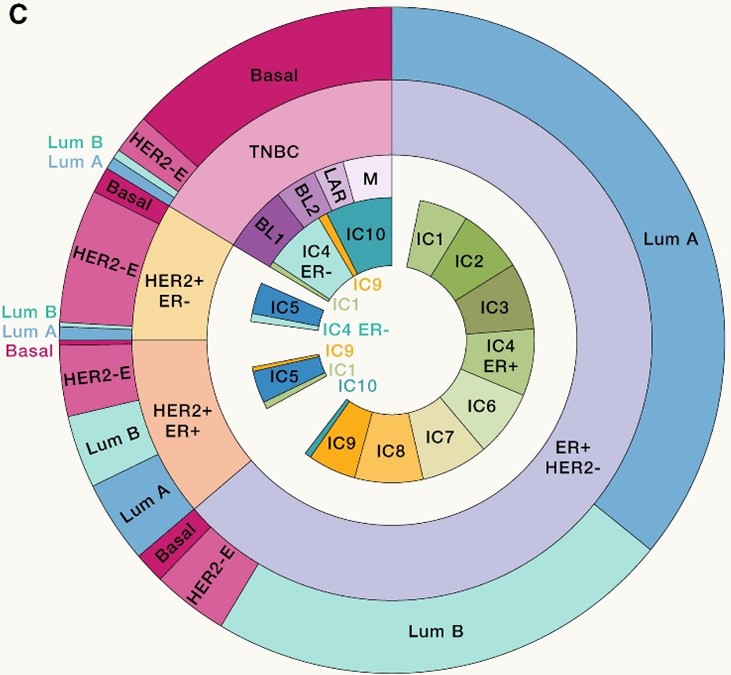
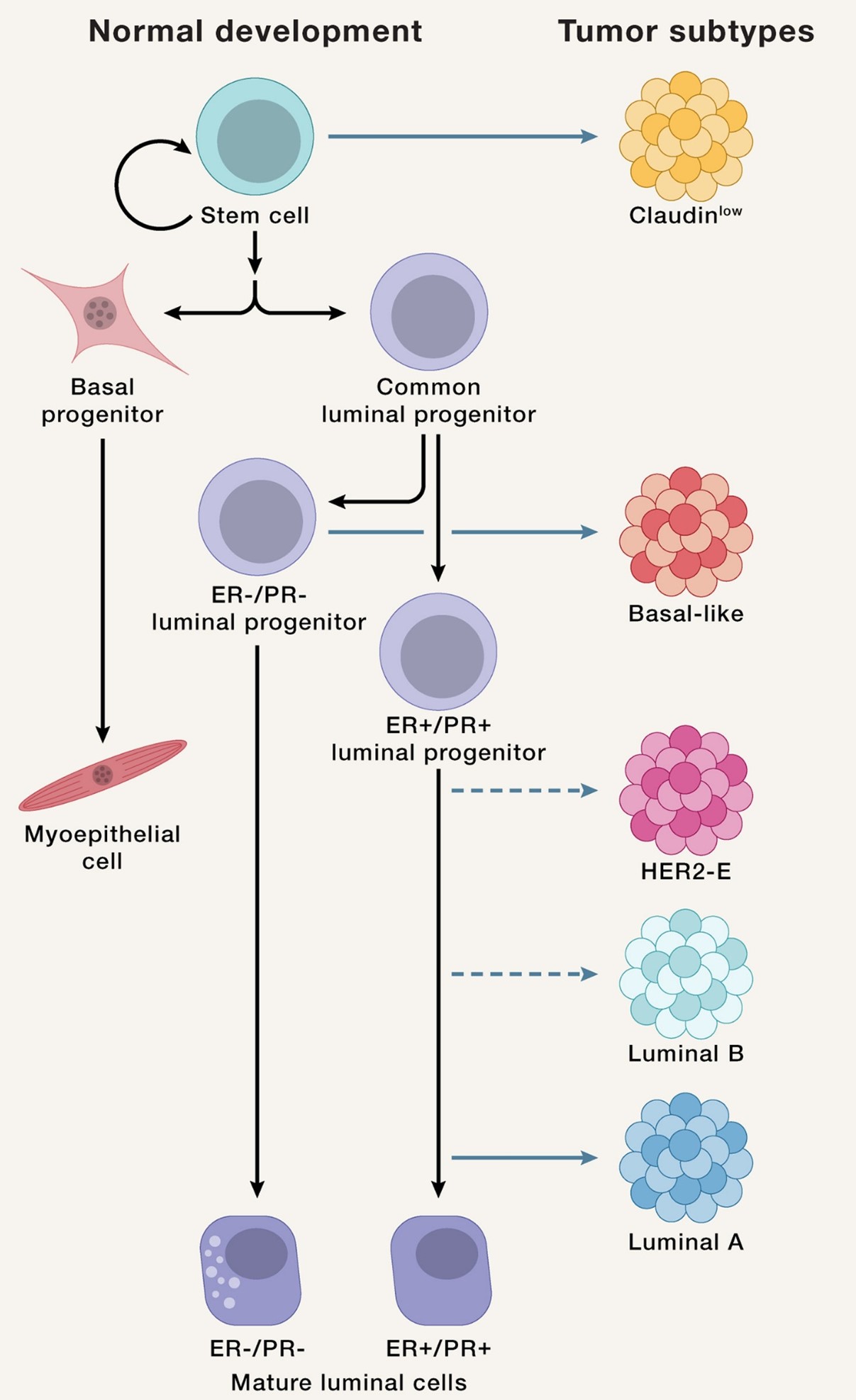
- 乳腺癌的分子分型(乳腺癌细胞和乳腺干细胞有惊人的相似性,提示我们分型差异源自于不同的乳腺上皮细胞在不同条件下发生的恶性转化):
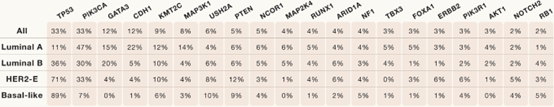
a) 基于RNA微阵列数据的分型:Luminal A、Luminal B、HER-2-enriched、basal-like、claudin-low:
- Luminal A:
- 低级别ER+PR+肿瘤;
- 表达Luminal Signature:ESR1、GATA3、XBP1、FOXA1;
- 预后更好;
- Luminal B:
- 高级别ER+肿瘤;
- 表达较低的Luminal Signature,表达更高的增殖相关基因;
- HER2-E:
- ERBB2扩增;
- 中等表达Luminal Signature;
- HER2-E和临床HER2+分型有很大重合但不完全一致;部分HER2-E患者的分子图谱和HER2-肿瘤一致;HER2+ER-患者中有70%为HER2-E;
- Basal-like(80% TNBC):
- 表达基底角蛋白和EGFR;
- 低表达Luminal Signature;
- 高度增殖、预后较差;
- 基因组不稳定,和BRCA1胚系突变相关;
- 分子图谱接近高级别浆液性卵巢癌;
- Claudin-low肿瘤(一般都是TNBC):
- 低表达增殖特征、低表达粘附蛋白、低表达Luminal Signature;
- 有间叶组织(mesenchymal)表型;
- 对化疗不敏感。
b) 2021年,Thennavan等人基于TCGA数据库,整合多组学数据进行分型(Thennavan, et al. Cell Genomics. 2021.):
c) 临床使用的芯片分型:
- Oncotype DX-gene recurrence score(21-gene panel);
- MammaPrint(70-gene panel);
- PAM50(50-gene panel)。
- 乳腺癌的基因组景观(乳腺癌的基因组景观是CNA主导的)
a) Luminal A:
- 最多的复发突变基因(recurrently mutated genes):PIK3CA(~45%)
- 最少的突变数目、最少的拷贝数变化;
b) Luminal B:
- 更高频率的TP53突变;甲基化程度增高;
- 特征性拷贝数变化(copy number alterations)和局灶性扩增(focal amplifications);
c) HER2-E:高突变负担(TP53,75%和PIK3CA,40%)、ERBB2扩增;
d) Basal-like:复杂的CNA、重排和突变负担、TP53突变(80%)。
- 乳腺癌的分型策略
a) Lehmann分型:2011年,Lehmann等通过对587例TNBC的基因表达谱进行聚类分析,提出将TNBC分为6个分子亚型:基底样-1型(BL-1)、基底样-2型(BL-2)、免疫调节型(IM)、间充质型(M)、间质干细胞型(MSL)及雄激素受体型(LAR)。2016年,该团队发现IM和MSL亚型起源于浸润的淋巴细胞和肿瘤相关基质细胞,因此将TNBC上述6种分子分型修正为4种类型即BL-l、BL-2、M和LAR亚型。
b) Burstein分型:2015年,Burstein等采用WGS对198例TNBC进行了分析,将TNBC划分为4种亚型即LAR、间充质型(MES)、基底样免疫抑制型(BLIS)和基底样免疫激活型(BLIA)。BLIA型TNBC预后较好,而BLIS型预后较差。
c) 复旦分型:2016年邵志敏课题组对中国465例原发性TNBC的临床资料、全基因组和转录组的测序数据进行了全面分析,该项研究更好地反映出中国TNBC患者的基因表型特征。基于转录组测序分析数据,将中国TNBC的分子亚型分为4类:LAR、IM、BLIS和MES。2019年该团队进一步验证了上述“复旦四分型”的准确性,并揭示基于分子分型的靶向药物选择是TNBC精准治疗的重要依据。